
Bài tập về sự điện phân
Hóa học vô cơ
Đánh giá năng lực;ĐHQG Hồ Chí Minh
Số câu hỏi: 31 câuSố mã đề: 1 đềThời gian: 1 giờ
166,057 lượt xem 12,768 lượt làm bài
Xem trước nội dung:
Điện phân 200 ml dung dịch CuSO4với I = 1,93 A tới khi catot bắt đầu có bọt khí thoát ra thì dừng lại, cần thời gian là 250 giây. Thể tích khí thu được ở anot (đktc) là
Điện phân l00 ml dung dịch CuSO40,2M với cường độ dòng điện I = 9,65A. Khối lượng Cu bám trên catot khi thời gian điện phân t1 = 200s và t2= 500s (hiệu suất điện phân là 100%) lần lượt là
Điện phân một lượng dư dung dịch KCl với điện cực trơ, màng ngăn xốp thời gian 16,1 phút dòng điện I = 5A thu được 500 ml dung dịch X. pH của dung dịch X có giá trị là
Điện phân 500 ml dung dịch AgNO3với điện cực trơ cho đến khi catot bắt đầu có khí thoát ra thì ngừng điện phân. Để trung hòa dung dịch sau điện phân cần 800 ml dung dịch NaOH 1M. Biết I = 20 A, nồng độ mol AgNƠ3và thời gian điện phân lần lượt là
Điện phân dung dịch CuSO4với điện cực trơ, cường độ dòng điện 10A. Khi ở anot có 4 gam khí oxi bay ra thì ngưng. Phát biểu nào sau đây là đúng ?
Điện phân dung dịch hồn hợp chứa 0,04 mol AgNO3và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là
Điện phân dung dịch X gồm 0,04 mol AgNO3và 0,06 mol Fe(NO3)3với I = 5,36A, điện cực trơ, sau t giây thấy catot tăng 5,44 gam. Giá trị của t là
Điện phân 500 ml dung dịch hỗn họp FeSO40,1M, Fe2(SO4)30,2M và CuSO40,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
Điện phân 400ml dd AgNO30,2M và Cu(NO3)20,1M với cường độ dòng điện
I = 10A, anot bằng Pt. Sau thời gian t, ta ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%)
Dung dịch X chứa HCl, CuSO4, Fe2(SO4)3. Lấy 400 ml dung dịch X đem điện phân với điện cực trơ, I = 7,72A đến khi ở catot thu được 5,12 gam Cu thì dừng lại. Khi đó chỉ thu được 0,1 mol một chất khí duy nhất thoát ra ở anot. Thời gian điện phân và nồng độ [Fe2+] sau điện phân lần lượt là
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
Cho dãy điện hóa sau:
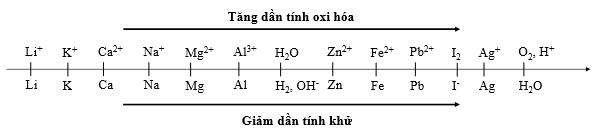
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4, Fe2(SO4)3, HNO3, Al(NO3)3bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3và 0,05 mol Cu(NO3)2với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC).
Trong Thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
Cho dãy điện hóa sau:
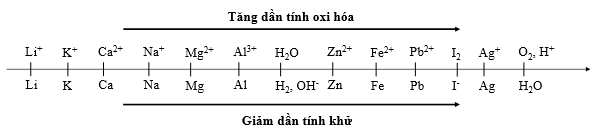
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4, Fe2(SO4)3, HNO3, Al(NO3)3bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3và 0,05 mol Cu(NO3)2với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC).
Trong Thí nghiệm 1, kim loại bám vào catot sau khi dừng điện phân là
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
Cho dãy điện hóa sau:
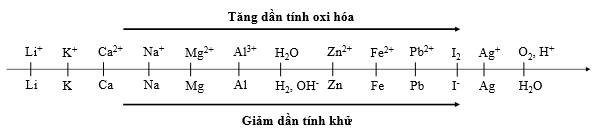
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4, Fe2(SO4)3, HNO3, Al(NO3)3bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3và 0,05 mol Cu(NO3)2với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC).
Trong Thí nghiệm 2, giá trị của m là
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
Cho dãy điện hóa sau:
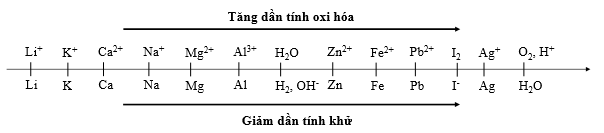
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)3, Mg(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3và 0,06 mol Fe(NO3)3với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Trong Thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
Cho dãy điện hóa sau:
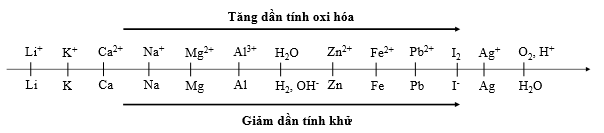
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)3, Mg(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3và 0,06 mol Fe(NO3)3với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Trong Thí nghiệm 1, thứ tự kim loại sinh ra tại catot là
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
Cho dãy điện hóa sau:
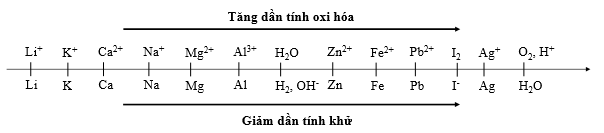
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)3, Mg(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3và 0,06 mol Fe(NO3)3với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Trong Thí nghiệm 2, giá trị của t là
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
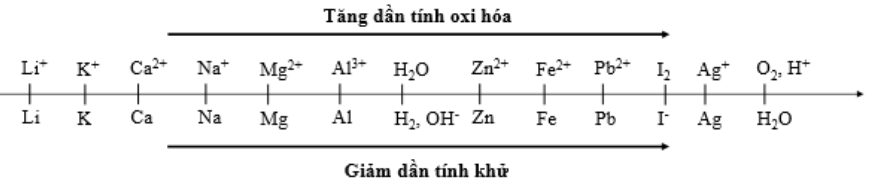
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2và Al(NO3)3bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
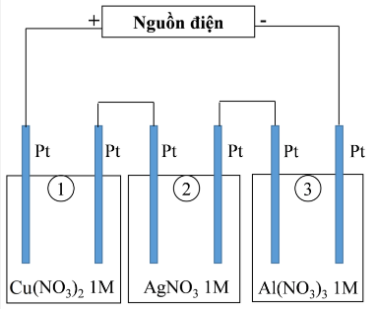
Sau một thời gian, sinh viên quan sát thấy có 3,84 gam kim loại đồng bám lên điệc cực của bình 1. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở catot?
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
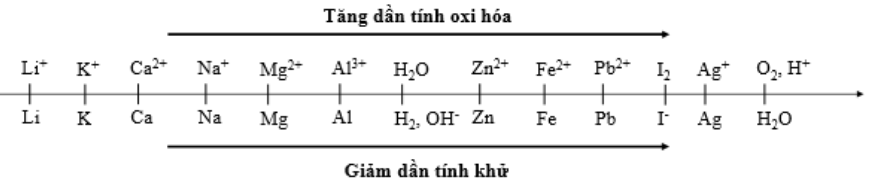
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2và Al(NO3)3bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
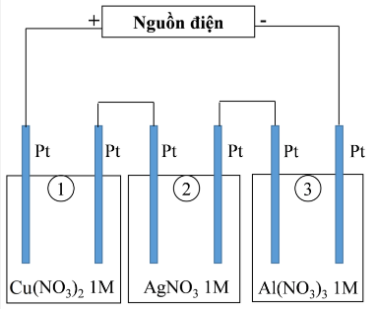
Sau một thời gian, sinh viên quan sát thấy có 3,84 gam kim loại đồng bám lên điệc cực của bình 1. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Nếu trong thí nghiệm 1, người sinh viên đổi 2 điện cực than chì bằng 2 điện cực kim loại Pb, phản ứng nào xảy ra ở catot và anot?
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
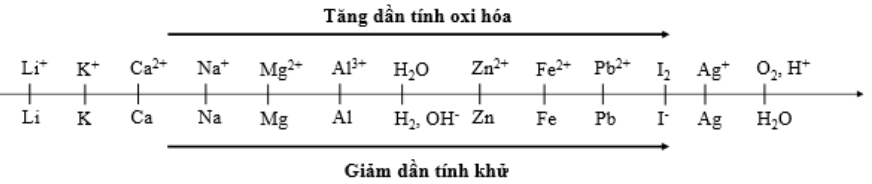
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2và Al(NO3)3bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
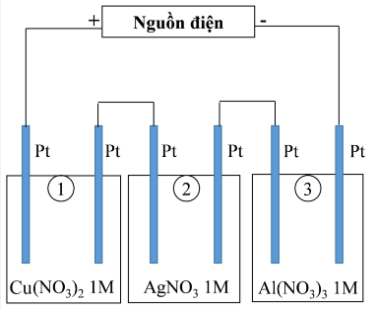
Sau một thời gian, sinh viên quan sát thấy có 3,84 gam kim loại đồng bám lên điệc cực của bình 1. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Trong thí nghiệm 2, số gam kim loại Ag bám lên điện cực trong bình 2 là
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Nếu điện phân chứa các gốc axit có chứa oxi NO3-, SO42-, PO43-, CO32-, ClO4-, … thì nước sẽ tham gia điện phân theo phương trình: 2H2O → O2+ 4H++ 4e.
+ Thứ tự anion bị oxi hóa: S2->I->Br->Cl->RCOO->OH->H2O.
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu điện phân dung dịch có các cation K+, Na+, Ca2+, Ba2+, Mg2+, Al3+thì nước sẽ tham gia điện phân theo phương trình: 2H2O + 2e → H2+ 2OH-.
+ Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan).
Thí nghiệm 1:Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2bằng hệ điện phân sử dụng điện cực Cu.
Thí nghiệm 2:Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5.
TừThí nghiệm 1, cho biết bán phản ứng nào xảy ra ở anot?
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Nếu điện phân chứa các gốc axit có chứa oxi NO3-, SO42-, PO43-, CO32-, ClO4-, … thì nước sẽ tham gia điện phân theo phương trình: 2H2O → O2+ 4H++ 4e.
+ Thứ tự anion bị oxi hóa: S2->I->Br->Cl->RCOO->OH->H2O.
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu điện phân dung dịch có các cation K+, Na+, Ca2+, Ba2+, Mg2+, Al3+thì nước sẽ tham gia điện phân theo phương trình: 2H2O + 2e → H2+ 2OH-.
+ Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan).
Thí nghiệm 1:Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2bằng hệ điện phân sử dụng điện cực Cu.
Thí nghiệm 2:Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5.
Nếu trongThí nghiệm 1, sinh viên đó thay điện cực Cu bằng điện cực than chì thì bán phản ứng xảy ra ở anot là:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Nếu điện phân chứa các gốc axit có chứa oxi NO3-, SO42-, PO43-, CO32-, ClO4-, … thì nước sẽ tham gia điện phân theo phương trình: 2H2O → O2+ 4H++ 4e.
+ Thứ tự anion bị oxi hóa: S2->I->Br->Cl->RCOO->OH->H2O.
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu điện phân dung dịch có các cation K+, Na+, Ca2+, Ba2+, Mg2+, Al3+thì nước sẽ tham gia điện phân theo phương trình: 2H2O + 2e → H2+ 2OH-.
+ Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan).
Thí nghiệm 1:Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2bằng hệ điện phân sử dụng điện cực Cu.
Thí nghiệm 2:Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5.
TừThí nghiệm 2, khối lượng dung dịch giảm là
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
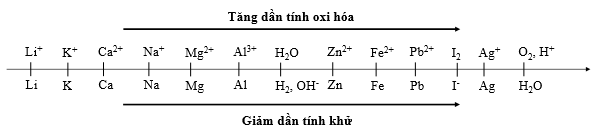
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
ận biết
Trong thí nghiệm 1, thứ tự điện phân các cation tại catot là
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
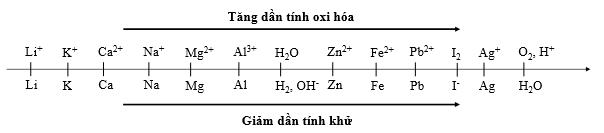
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Trong thí nghiệm 1, giá trị pH của dung dịch thay đổi như thế nào ?
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2+ 4H++ 4e
+ Thứ tự anion bị điện phân: S2->I->Br->Cl->RCOO->OH->H2O
*Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2+ 2OH-
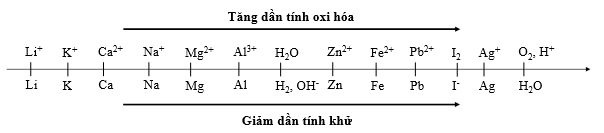
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Trong thí nghiệm 2, thể tích khí thoát ra tại điện cực anot là
Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Điện phân dung dịch X chứa hỗn hợp gồm CuSO4và NaCl (tỉ lệ mol tương ứng 1:3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi 2A. Sau thời gian điện phân t (giờ) thu được dung dịch Y (chứa 2 chất tan) có khối lượng giảm 12,45 gam so với dung dịch X. Dung dịch Y phản ứng vừa hết với 3,06 gam Al2O3. Bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước, hiệu suất điện phân 100%. Giá trị của t gần nhất với giá trị nào sau đây?
Đề thi tương tự
1 mã đề 20 câu hỏi 1 giờ
172,530 xem13,266 thi
1 mã đề 20 câu hỏi 1 giờ
170,554 xem13,114 thi
1 mã đề 25 câu hỏi 1 giờ
175,577 xem13,500 thi
1 mã đề 10 câu hỏi 1 giờ
157,550 xem12,105 thi
1 mã đề 21 câu hỏi 1 giờ
174,226 xem13,394 thi
1 mã đề 18 câu hỏi 1 giờ
157,293 xem12,092 thi
1 mã đề 21 câu hỏi 1 giờ
150,522 xem11,563 thi
