
Đề thi thử THPT QG môn Hóa học năm 2018
Đề thi nằm trong bộ sưu tập: 📘 Tuyển Tập Bộ Đề Thi Ôn Luyện THPT Quốc Gia Môn Hóa Học Các Trường (2018-2025) - Có Đáp Án Chi Tiết 🧪📘 Tuyển Tập Đề Thi Tham Khảo Các Môn THPT Quốc Gia 2025 🎯
Số câu hỏi: 40 câuSố mã đề: 1 đềThời gian: 1 giờ
136,089 lượt xem 10,461 lượt làm bài
Xem trước nội dung:
Cation M+ có cấu hình electron lớp ngoài cùng 2s22p6 là
Polime nào sau đây được điều chế bằng phản ứng đồng trùng hợp?
Cách bảo quản thực phẩm (thịt, cá,...) bằng cách nào sau đây được coi là an toàn?
Cacbohidrat nào có nhiều trong cây mía và củ cải đường?
Phản ứng thủy phân este trong môi trường kiềm gọi là phản ứng:
Nhiệt phân hiđroxit Fe (II) trong không khí đến khi khối lượng không đổi thu được chất rắn là:
Trường hợp nào sau đây tạo sản phẩm là ancol và muối natri của axit cacboxylic?
Trong chất thải của một nhà máy có chứa các ion: Cu2+, Zn2+, Fe3+, Pb2+, Hg2+,...
Có thể dùng chất nào sau đây để xử lý sơ bộ các chất thải trên?
Số đipeptit tối đa có thể tạo ra từ một hỗn hợp gồm alanin và glyxin là
Một cốc nước cứng có chứa 0,1 mol Ca2+; a mol K+; 0,15 mol Cl– và b mol HCO3–. Thêm vào cốc 0,1 mol Ca(OH)2 thì mất hoàn toàn tính cứng, dung dịch trong cốc chỉ chứa duy nhất một muối. Đun sôi cốc nước cứng trên đến cạn thu được lượng chất rắn khan là
Để điều chế Ag từ quặng chứa Ag2S bằng phương pháp thủy luyện người ta cần dùng thêm
Đốt cháy hoàn toàn 1 mol anđehit X cần 1 mol O2 và thu được 1 mol H2O. Công thức cấu tạo của X là:
Cho 14,8 gam hỗn hợp gồm metyl axetat và axit propanoic tác dụng hết với dung dịch NaOH thu được dung dịch X. Số mol hỗn hợp muối có trong dung dịch X là:
Các chất sau, chất nào không phản ứng với Cu(OH)2 ở điều kiện thường?
Cho 10,84 gam hỗn hợp X (Fe, Cu, Ag) hòa tan hoàn toàn bằng dung dịch HNO3 thấy giải phóng 1,344 lít khí NO (đktc), (sản phẩm khử duy nhất) thu được m gam hỗn hợp muối. Giá trị của m là bao nhiêu ?
Hòa tan 1,86 gam hợp kim của Mg và Al trong dung dịch HNO3 loãng, dư thu được 560 ml khí N2O (sản phẩm khử duy nhất ở đktc). Thành phần % theo khối lượng của Mg và Al trong hợp kim là
Từ 20kg gạo nếp chứa 81% tinh bột, khi lên men thu được bao nhiêu lít ancol 96o? Biết hiệu suất quá trình lên men đạt 81% và ancol etylic có khối lượng riêng D = 0,789 g/ml.
Có ba chất lỏng benzen, phenol, stiren đựng trong 3 lọ mất nhãn riêng biệt. Thuốc thử để phân biệt ba chất lỏng trên là:
Phương trình hóa học nào sau đây là sai?
Dung dịch A chứa a mol Ba(OH)2. Cho m gam NaOH vào A sau đó sục CO2 (dư) vào ta thấy lượng kết tủa biên đổi theo đồ thị (Hình bên). Giá trị của a và m là
NH3 thể hiện tính khử trong phản ứng nào sau đây?
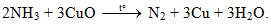

Khi brom hóa một ankan chỉ thu được một dẫn xuất monobrom duy nhất có tỉ khối hơi đối với hiđro là 75,5. Tên của ankan đó là
Cho dãy các kim loại: Na; Al; Cu; Fe; Ag. Số kim loại tác dụng được với dung dịch Fe2(SO4)3 là:
Làm sạch etan có lẫn etilen thì phải
Cho 2a mol bột Fe vào dung dịch chứa 5a mol AgNO3, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch gồm các muối nào?
Để chứng minh trong phân tử của glucozơ có nhiều nhóm hiđroxyl, người ta cho dung dịch glucozơ phản ứng với
Hòa tan hoàn toàn 8,45 gam một kim loại hóa trị II bằng dung dịch HCl. Cô cạn dung dịch sau phản ứng được 17,68 gam muối khan. Kim loại trên là kim loại nào sau đây?
Phản ứng nào sau đây có phương trình ion thu gọn là: 2H+ + S2- → H2S?
Trong các thí nghiệm sau:
(1) Mg phản ứng với dung dịch HNO3 loãng.
(2) Fe tác dụng với dung dịch H2SO4 đặc nóng.
(3) Cho từ từ đến dư dung dịch HCl vào dung dịch Na2CO3.
(4) K tác dụng với dung dịch CuSO4.
(5) CO2 tác dụng với dung dịch Ca(OH)2 dư.
(6) dung dịch NaHCO3 tác dụng với dung dịch H2SO4 loãng.
(7) FeO tác dụng với dung dịch HNO3 loãng.
Số thí nghiệm chắc chắn có khí thoát ra là
Hỗn hợp M gồm axit cacboxylic X và este Y (đều đơn chức và cùng số nguyên tử cacbon). Cho m gam M phản ứng vừa đủ với dung dịch chứa 0,25 mol NaOH, sinh ra 18,4 gam hỗn hợp hai muối. Mặt khác, cũng cho m gam M trên tác dụng với lượng dư dung dịch AgNO3 trong NH3 đun nóng kết thúc phản ứng thu được 332,4 gam Ag. Công thức của X và giá trị của m lần lượt là
Chất A là một α-aminoaxit mạch cacbon không phân nhánh. Cho 0,1 mol A vào dung dịch chứa 0,25 mol HCl dư, thu được dung dịch B. Để phản ứng hết với dung dịch B cần vừa đủ 300ml dung dịch NaOH 1,5M đun nóng, sau phản ứng thu được dung dịch D. Nếu cô cạn dung dịch D, thì thu được 33,725 gam chất rắn khan. Tên của A là:
Cho các chất sau: keo dán ure-fomanđehit; tơ lapsan, tơ nilon-6,6; protein; sợi bông; amoni axetat; nhựa novolac; tơ nitron. Trong các chất trên, có bao nhiêu chất mà trong phân tử chúng có chứa nhóm -NH-CO-?
X có công thức C4H14O3N2. Khi cho X tác dụng với dung dịch NaOH thì thu được hỗn hợp Y gồm 2 khí ở điều kiện thường và đều có khả năng làm xanh quỳ tím ẩm. Số công thức cấu tạo phù hợp của X là:
Khi đốt cháy hoàn toàn 0,42 gam một hiđrocacbon X thu được toàn bộ sản phẩm qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH dư. Kết quả: bình 1 tăng 0,54 gam; bình 2 tăng 1,32 gam. Biết rằng khi hóa hơi 0,42 gam X chiếm thể tích bằng thể tích của 0,32 gam O2 ở cùng điều kiện. X có công thức phân tử là
Cho các chất sau: Al; Al2O3; NH2C2H4COOH; NaHCO3; AlCl3; SO2; Al(OH)3. Số chất lưỡng tính trong dãy trên là:
Hòa tan hết 4,667 gam hỗn hợp X gồm Na, K, Ba, ZnO trong đó oxi chiếm 5,14% về khối lượng và H2O được dung dịch Y và 0,032 mol H2. Cho 88 ml dung dịch HCl 1M vào Y thu được m gam kết tủa. Tính m.
Hỗn hợp M gồm 3 este đơn chức X, Y, Z (MX < MY < MZ và số mol của Y bé hơn số mol X) tạo thành từ cùng một axit cacboxylic (phân tử chỉ có nhóm –COOH) và ba ancol no (số nguyên từ C trong phân tử mỗi ancol nhỏ hơn 4). Thủy phân hoàn toàn 34,8 gam M bằng 49 0mL dung dịch NaOH 1M (dư 40% so với lượng phản ứng). Cô cạn hỗn hợp sau phản ứng thu được 38,5 gam chất rắn khan. Mặt khác, nếu đốt cháy hoàn toàn 34,8 gam M trên thì thu được CO2 và 23,4 gam H2O. Thành phần phần trăm theo khối lượng Y trong M là
Hòa tan m gam hỗn hợp A gồm FexOy Fe và Cu bằng dung dịch chứa 1,8 mol HCl và 0,3 mol HNO3, sau phản ứng thu được 5,824 lít khí NO (đktc, sản phẩm khử duy nhất) và dung dịch X chứa (m + 60,24) gam chất tan. Cho a gam Mg vào dung dịch X, kết thúc phản ứng thu được (m –6,04) gam chất rắn và hỗn hợp Y gồm hai khí (trong đó có một khí hóa nâu trong không khí) có tỉ khối so với He bằng 4,7. Giá trị của a gần nhất với
Điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây khối lượng kim loại bám vào catot là:
Ba peptit X, Y, Z (MX < MY < MZ) mạch hở, có cùng số nguyên tử cacbon, được tạo bởi từ glyxin, alanin, valin; tổng số liên kết peptit trong X, Y, Z bằng 8. Đốt cháy hoàn toàn 27,95 gam hỗn hợp E chứa X, Y, Z (trong đó X chiếm 75% số mol hỗn hợp) với lượng oxi vừa đủ, sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua bình đựng dung dịch Ca(OH)2 dư, thu được 120 gam kết tủa. Khí thoát ra khỏi bình có thể tích là 3,472 lít (đktc). Biết độ tan của nitơ đơn chất trong nước là không đáng kể. Phần trăm khối lượng của Y có trong hỗn hợp E là:

.PNG)