
(2025 MỚI NHẤT) Đề Ôn Thi Tốt Nghiệp THPT Môn Hóa Học - Đề Số 8
Tham khảo ngay đề ôn thi tốt nghiệp THPT môn Hóa Học 2025 (Đề số 8) mới nhất, được thiết kế bám sát cấu trúc đề thi chính thức của Bộ Giáo dục. Đề thi bao gồm các câu hỏi lý thuyết và bài tập trọng tâm, hỗ trợ học sinh rèn luyện kiến thức và kỹ năng làm bài một cách hiệu quả. Đây là tài liệu cần thiết để tự tin đạt kết quả cao trong kỳ thi tốt nghiệp THPT môn Hóa Học. Đừng bỏ lỡ cơ hội nâng cao điểm số với bộ đề chất lượng này!
Từ khoá: đề ôn thi tốt nghiệp THPT môn Hóa Họcđề thi thử Hóa Học 2025đề số 8 ôn thi môn Hóa Họctài liệu ôn thi Hóa Học THPTđề thi môn Hóa Học mới nhất 2025luyện thi THPT môn Hóa Học hiệu quảcấu trúc đề thi Hóa Học THPT 2025ôn thi tốt nghiệp THPT môn Hóa Học đạt điểm caođề thi thử môn Hóa Học 2025đề ôn thi môn Hóa Học chất lượng cao
Đề thi nằm trong bộ sưu tập: 📘 Tuyển Tập Đề Thi Tham Khảo Các Môn THPT Quốc Gia 2025 🎯📘 Tuyển Tập Bộ Đề Thi Ôn Luyện THPT Quốc Gia Môn Hóa Học Các Trường (2018-2025) - Có Đáp Án Chi Tiết 🧪
Số câu hỏi: 28 câuSố mã đề: 1 đềThời gian: 1 giờ
290,852 lượt xem 22,368 lượt làm bài
Xem trước nội dung:
Vinyl acetate là một monomer quan trọng dể sản xuất polymer trong công nghiệp dệt may, hoá chất, dược phẩm, chất dẻo, cao su,... Quá trình điều chế vinyl acetate trong công nghiệp từ ethylene được thực hiện với sự có mặt của kim loại Pd như sau:
Biết hiệu suất chuyển hoá ethylene thành vinyl acetate đạt 80%. Khối lượng vinyl acetate điều chế được từ 2,8 tấn ethylene ban đầu là
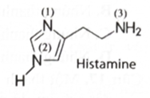
Hiện nay, thuốc kháng histamine được sử dụng khá phổ biến trong điều trị dị ứng. Công thức cấu tạo của histamine như hình bên. Bậc amine của nguyên tử nitrogen số 2 là
Hình ảnh sau đây minh họa tính chất vật lí nào của kim loại?

Vàng Au đơn chất tồn tại trong tự nhiên ở trong quặng vàng thường có hàm lượng vàng thấp. Để thu hồi vàng từ quặng vàng, người ta nghiền quặng, hoà tan chúng vào dung dịch KCN và liên tục sục không khí vào. Vàng bị hoà tan tạo thành phức chất:
và sau đó kết tủa vàng bằng kẽm Zn:
Nếu dùng 13 kg KCN thì có thể tách được bao nhiêu kg vàng từ quặng theo chuỗi phản ứng trên? Giả thiết các chất khác trong quặng không phản ứng với KCN.
Một thanh Mg nặng được gắn vào một đường ống bằng thép chôn dưới đất sét ẩm để chống ăn mòn cho đường ống. Khi đó sẽ xuất hiện một dòng điện (gọi là dòng điện bảo vệ) có cường độ chạy giữa thanh Mg và đường ống. Điện lượng của pin điện hoá được xác định bởi biểu thức:
Trong đó: I là cường độ dòng điện ; t là thời gian pin hoạt động (giây); F là hằng số Faraday, là số mol electron trao đổi giữa hai điện cực. Biết hiệu suất bảo vệ đối với Mg là 50%. Khoảng thời gian đường ống có thể được bảo vệ bởi thanh Mg khỏi các quá trình ăn mòn kim loại là
Cationite là một loại nhựa trao đổi cation được sử dụng để loại bỏ ion Khi nước cứng đi qua cột nhựa, các ion (kí hiệu chung là ) sẽ được giữ lại và thay thế bằng các ion theo phản ứng sau:
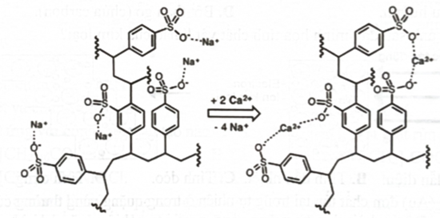
Một loại cationite có % khối lượng lượng sulfur là 7,94% được sử dụng để loại bỏ các ion trong nước cứng. Giả sử một cột nhựa trao đổi ion trong thiết bị lọc nước gia đình có khối lượng cationite là thì số tối đa có thể được loại bỏ là
Trong mỗi ý a, b, c, dở mỗi câu, thí sinh chọn đúng hoặc sai.
Phân tích nguyên tố hợp chất hữu cơ E cho kết quả phần trăm khối lượng carbon, hydrogen và oxygen lần lượt là 54,55 % ; 9,09 % và 36,36 %. Dựa vào phương pháp phân tích khối phổ (MS) xác định được phân tử khối của E là 88. Mặt khác, phổ hồng ngoại (IR) cho thấy phân tử E không chứa nhóm -OH (peak có số sóng ) nhưng lại chứa nhóm
Thuỷ phân hoàn toàn E trong dung dịch NaOH, thu được muối của carboxylic acid X và chất Y. Chất Y có nhiệt độ sôi nhỏ hơn nhiệt độ sôi của ethanol (nhiệt độ sôi đều đo ở áp suất 1 atm).
Poly(ethylene terephthalate) (viết tắt là PET) được điều chế theo sơ đồ phản ứng sau:
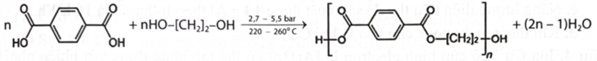
PET có mã số kí hiệu trên sản phẩm là số 1 và thuộc loại polymer nhiệt dẻo phổ biến nhất, có thể tái chế và được sử dụng để dệt sợi may quần áo, thảm, đồ hộp đựng chất lỏng và thực phẩm, ...
có nhiệt độ nóng chảy rất cao nên việc điện phân nóng chảy nguyên chất sẽ khó thực hiện. Hiện nay, theo công nghệ Hall-Héroult, người ta hoà tan trong cryolite nóng chảy được hỗn hợp chất điện phân có nhiệt độ nóng chảy thấp hơn (khoảng gần ). Giải pháp này giúp tiết kiệm năng lượng, đồng thời tạo ra chất lỏng có tính dẫn điện tốt, nhẹ hơn Al và nổi lên phía trên lớp Al lỏng, bảo vệ Al không bị oxi hoá bởi không khí. Sơ đồ thùng điện phân được biểu diễn như hình dưới:
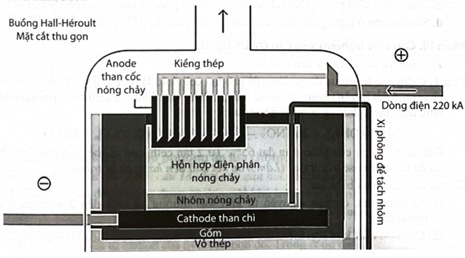
Quá trình điện phân được tiến hành với dòng điện có hiệu điện thế thấp (khoảng 5 V) và cường độ dòng điện Để sản xuất được 1 tấn Al cần tiêu tốn khoảng 2 tấn cryolite, 400 kg than cốc.
Cho biết: Năng lượng điện tiêu thụ theo lí thuyết, Với: là khối lượng Al được điều chế (gam); F là hằng số Faraday, là hiệu điện thế áp đặt vào hai cực của bình điện phân.
Ion có cấu hình electron là có thể tạo phức được với nhiều phối tử bằng liên kết cho nhận giữa phối tử với các orbital trống của ion Một thí nghiệm về sự tạo thành hợp chất phức được thực hiện như sau:
Hoà tan hoàn toàn một lượng muối khan (màu trắng) vào nước, thu được dung dịch X có màu xanh.
Thêm tiếp dung dịch vào dung dịch X, thu được kết tủa màu xanh nhạt.
Tiếp tục thêm dung dịch đặc đến dư vào đến khi kết tủa bị hoà tan, thu được dung dịch Y có màu xanh lam. Chuỗi thí nghiệm trên được biểu diễn qua sơ đồ sau:
Màu xanh của kết tủa và dung dịch được lí giải là do sự hình thành các ion phức trong hợp chất phức gây ra.
Cellulose trinitrate được dùng để chế tạo celluloid là một loại vật liệu để sản xuất nhạc cụ, thiết bị văn phòng, thân bút máy,... Phản ứng điều chế cellulose trinitrate được thực hiện theo phương trình hoá học sau:
Giả sử hiệu suất của phản ứng đạt 65%. Từ 2 tấn cellulose có thể điều chế được bao nhiêu tấn cellulose trinitrate? (Làm tròn kết quả đến hàng phần trăm)
Cho các phát biểu sau:
(1) Ở trạng thái cơ bản, nguyên tử kim loại thường có từ 1 đến 3 electron ở lớp ngoài cùng.
(2) Các đơn chất kim loại kiềm thổ đều tan được trong nước ở điều kiện thường.
(3) Hợp chất tạo bởi các kim loại chuyển tiếp dãy thứ nhất thường có màu sắc.
(4) Trong tự nhiên, các kim loại đều tồn tại ở dạng hợp chất.
Liệt kê các phát biểu đúng theo số thứ tự tăng dần.
Bia, rượu, giấm ăn đều có thể được sản xuất từ nguyên liệu ban đầu là tinh bột trong ngũ cốc theo sơ đồ phản ứng sau:
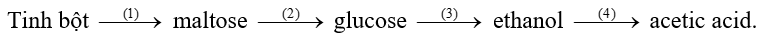
Phản ứng nào trong chuỗi phản ứng trên thuộc loại phản ứng thuỷ phân? (Liệt kê theo số thứ tự phản ứng tăng dần)
Cho các thí nghiệm sau:
(1) Cho 3 mL dung dịch vào 3 mL nước nhiễm phèn.
(2) Sục khí vào dung dịch bão hoà NaCl và ở
(3) Đun nóng nước có tính cứng tạm thời.
(4) Cho 3 mL dung dịch vào 3 mL dung dịch
Liệt kê các thí nghiệm thu được kết tủa theo số thứ tự tăng dần.
Enzyme tripsine chủ yếu xúc tác cho phản ứng thuỷ phân liên kết peptide tạo bởi nhóm carboxyl của amino acid mà gốc R có tính base. Thuỷ phân peptide Val-Lys-Ala-Gly-Lys-Gly-Val-Lys-Gly-Lys-Val với xúc tác là enzyme tripsine thì có thể thu được tối đa bao nhiêu tripeptide?
Tiến hành thí nghiệm theo các bước sau:
Bước 1. Lấy hai ống nghiệm sạch, cho 3 mL dung dịch vào ống (1), cho 3 mL dung dịch và giọt dung dịch vào ống (2).
Bước 2. Cho đồng thời vào hai ống, mỗi ống một đinh sắt có kích thước như nhau đã được làm sạch bề mặt rồi để yên một thời gian.
Cho các phát biểu sau:
(1) Ở bước 2, tốc độ thoát khí ở ống (1) và ống (2) là như nhau.
(2) Ở bước 2, ống (1) chỉ xảy ra ăn mòn hoá học, ống (2) chỉ xảy ra ăn mòn điện hoá.
(3) Ở bước 2, cả hai ống đều xảy ra quá trình oxi hoá Fe thành
(4) Ở bước 2, trong ống (2) có chất rắn màu đỏ cam bám lên bề mặt đinh sắt.
(5) Nếu thay dung dịch bằng thì khí thoát ra ở ống (2) sẽ nhanh hơn ống (1).
Liệt kê các phát biểu đúng theo số thứ tự tăng dần.
Đề thi tương tự
1 mã đề 28 câu hỏi 1 giờ
305,838 xem23,515 thi
1 mã đề 28 câu hỏi 1 giờ
318,610 xem24,502 thi
1 mã đề 28 câu hỏi 1 giờ
278,080 xem21,383 thi
1 mã đề 28 câu hỏi 1 giờ
289,825 xem22,283 thi
1 mã đề 28 câu hỏi 1 giờ
308,475 xem23,723 thi
1 mã đề 28 câu hỏi 1 giờ
231,796 xem17,820 thi
1 mã đề 28 câu hỏi 1 giờ
224,600 xem17,271 thi
1 mã đề 28 câu hỏi 1 giờ
228,827 xem17,592 thi
1 mã đề 28 câu hỏi 1 giờ
271,928 xem20,912 thi
