
Đề thi giữa HK2 môn Hóa học 10 năm 2021
Đề thi nằm trong bộ sưu tập: HÓA 10
Số câu hỏi: 40 câuSố mã đề: 1 đềThời gian: 1 giờ
136,687 lượt xem 10,511 lượt làm bài
Xem trước nội dung:
Kim loại nào sau đây không tác dụng với dung dịch HCl?
Kim loại M phản ứng được với dung dịch HCl, dung dịch H2SO4 đặc nguội. Kim loại M là:
Để trung hòa 30 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là:
Trong các chất sau, chất nào dễ tan trong nước?
Trường hợp nào sau đây xảy ra phản ứng hóa học?
Trong điều kiện thích hợp, xảy ra các phản ứng sau:
(a) 2H2SO4 + C → 2SO2 + CO2 + 2H2O
(b) 4H2SO4 + 2FeO → Fe2(SO4)3 + SO2 + 4H2O
(c) 6H2SO4 + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
(d) H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
Trong các phản ứng trên, phản ứng xảy ra tương ứng với tính chất của dung dịch H2SO4 loãng là:
Cho dãy các kim loại: Zn, Al, Cu, Fe, Ag. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là:
Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch H2SO4 loãng, dư. Sau khi phản ứng kết thúc, thể tích khí H2 (đktc) thoát ra là:
Cho 15,68 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 22,2 gam hỗn hợp Y gồm Mg và Al, thu được 60,2 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là:
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
Cho phản ứng của sắt với oxi như hình vẽ sau:
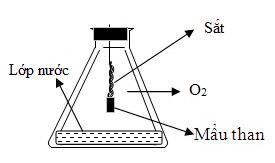
Vai trò của lớp nước ở đáy bình là
Ozon có khả năng “cải tạo” nước thải, có thể khử các chất độc như: phenol, hợp chất xianua, nông dược, chất trừ cỏ, các hợp chất hữu cơ gây bệnh... có trong nước thải. Ngoài ra ozon có thể tác dụng với ion kim loại ( sắt, thiếc, chì mangan...) biến nước thải thành nước vô hại, bảo quản hoa quả, thực phẩm... Ozon tồn tại thành một tầng khí quyển riêng trên tầng bình lưu, có khả năng hấp thụ tia tử ngoại phát ra từ mặt trời. Sở dĩ tầng ozon có khả năng trên là do
Khi sục SO2 vào dung dịch H2S, hiện tượng quan sát được là
Hòa tan m gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam Fe này vào dung H2SO4 đặc nóng thì lượng khí (đktc) sinh ra là
Trong các phản ứng sau đây, hãy chỉ ra phản ứng không đúng?
Công thức hóa học của oleum là
Cho sơ đồ phản ứng: .
X là?
Cho 6,72 gam Fe vào dung dịch chứa 0,3 mol H2SO4 đặc nóng thu được hỗn hợp A và V lít SO2 (đktc, sản phẩm khử duy nhất). Số mol các chất trong hỗn hợp A là
Khi dẫn khí SO2 vào dung dịch KMnO4 màu tím thì thấy dung dịch bị mất màu, phương trình hóa học của phản ứng xảy ra:
Vai trò của SO2 và KMnO4 trong phản ứng trên là
Khi cho Fe2O3 tác dụng với dung dịch H2SO4 đặc, nóng thì sản phẩm thu được là
Hòa tan hoàn toàn 2,18 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml dung dịch H2SO4 0,1M ( vừa đủ ). Khối lượng muối khan thu được sau khi cô cạn dung dịch là
Cho một hỗn hợp gồm các chất sau: Na, Cu, Al, ZnO, FeO, K2SO4, FeCO3, Ba(OH)2. Số chất có khả năng tham gia phản ứng với H2SO4 đặc, nguội là
Hòa tan hoàn toàn 6,5 gam kim loại M trong dung dịch H2SO4 loãng tạo thành 16,1 gam muối sunfat. Kim loại M là
Dùng thuốc thử nào sau đây để có thể phân biệt được các dung dịch NaOH, Ba(OH)2, H2SO4, NaCl?
Cho 0,2 mol SO2 tác dụng với 0,3 mol NaOH, sau phản ứng thu được m gam muối. Giá trị của m là
Cho các chất: S, SO2, SO3, H2S, H2SO4. Số chất vừa có tính oxi hóa, vừa có tính khử là
Một loại oleum có công thức hóa học là H2S4O13 (H2SO4.3SO3). Số oxi hóa của S trong hợp chất oleum là?
Cho 7,8 gam hỗn hợp 2 kim loại Mg và Al tác dụng với dung dịch H2SO4 loãng dư. Sau khi phản ứng kết thúc thu được 8,96 lít khí (đktc). Khối lượng của Mg và Al trong hỗn hợp ban đầu là
Cho hỗn hợp gồm FeS và FeCO3 tác dụng với dung dịch H2SO4 đặc, nóng thu được hỗn hợp khí A. Các khí trong hỗn hợp A là
Biện pháp nào sau đây không có tác dụng giảm thải H2S vào môi trường?
Oxi và ozon được gọi là thù hình của nhau vì
Đốt cháy 84 gam Fe bằng oxi không khí thu được 106,4 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4. Số mol oxi đã tham gia phản ứng là
Cho các nhận định sau:
1.Hg phản ứng với S ngay ở nhiệt độ thường.
2.Trong công nghiệp, axit sunfuric được sản xuất theo phương pháp tiếp xúc gồm ba giai đoạn.
3.Khi sục khi H2S vào dung dịch NaOH có thể thu được hai loại muối: Na2S và NaHS.
4.Axit sunfuric loãng không thể hiện tính oxi hóa.
5.Khi sục khí SO2 từ từ đến dư vào dung dịch Ba(OH)2 thì thấy có kết tủa trắng xuất hiện.
6.Ozon có tính oxi hóa mạnh hơn oxi do nó có thể tan trong nước tốt hơn oxi.
Số nhận định không đúng là
Có 5 mẫu kim loại gồm Ba, Mg, Fe, Al, Ag. Chỉ dùng H2SO4 loãng có thể nhận biết được bao nhiêu kim loại trong dãy trên?
Cho 10,5 gam hỗn hợp Zn và CuO phản ứng vừa đủ 300 ml dung dịch H2SO4 0,5M. Phần trăm khối lượng của Zn trong hỗn hợp ban đầu là
Bình đựng H2SO4 đặc để trong không khí ẩm một thời gian thì khối lượng bình thay đổi như thế nào?
Nguyên tử X có cấu hình electron của phân lớp có năng lượng cao nhất là 3p4 . Nhận xét nào là không đúng khi nói về nguyên tử X?
SO2 là một khí độc, khi hít phải không khí có SO2 sẽ gây hại cho sức khỏe ( gây viêm phổi, mắt, da...), nồng độ cao gây ra bệnh tật thậm chí tử vong. SO2 cũng là một trong các chất chủ yếu gây ô nhiễm môi trường vì khi tan trong nước mưa tạo thành axit gây ra sự ăn mòn kim loại và vật liệu. Tuy nhiên SO2 lại có nhiều ứng dụng: sản xuất axit sunsuric, tẩy tráng giấy, bột giấy, chóng nấm mốc cho lương thực, thực phẩm ... Phương pháp điều chế SO2 trong công nghiệp là
Dẫn 3,36 lít khí H2S (đktc) vào 150 ml dung dịch KOH 1M. Các chất thu được sau phản ứng là
Phát biểu nào sau đây đúng?
