Đề thi giữa HK2 môn Hóa học 10 năm 2021
Đề thi nằm trong bộ sưu tập: HÓA 10
Số câu hỏi: 40 câuSố mã đề: 1 đềThời gian: 1 giờ
115,937 lượt xem 8,915 lượt làm bài
Xem trước nội dung:
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
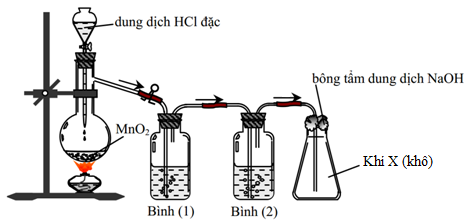
Cho sơ đồ thí nghiệm điều chế chất X:
Chất X là
Chất nào sau đây có tên gọi là lưu huỳnh trioxit?
Dẫn khí H2S vào dung dịch muối Pb(NO3)2, hiện tượng quan sát được là
Nước Gia-ven là dung dịch hỗn hợp chứa các chất tan:
Tiến hành thí nghiệm với axit H2SO4 đặc, nóng thường sinh ra khí SO2. Để ngăn chặn khí SO2 thoát ra gây ô nhiễm môi trường, người ta thường dùng bông tẩm dung dịch chất X để nút miệng ống nghiệm. X có thể là chất nào sau đây ?
Nguyên tắc pha loãng axit sunfuric đặc là
Chất khí Y được tìm thấy nhiều lần ở tầng bình lưu của khí quyển, có vai trò như một tấm lá chắn ngăn các bức xạ có hại từ Mặt Trời chiếu xuống Trái Đất, chất Y là:
Chỉ ra đâu không phải là ứng dụng của clorua vôi?
Hòa tan hết 0,1 mol Fe vào dung dịch H2SO4 loãng, dư, thu được bao nhiêu lít (đktc) khí H2?
Halogen có tính oxi hóa mạnh nhất là
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là:
Khí clo không phản ứng với chất nào sau đây?
Phương trình hóa học nào sau đây viết không đúng?
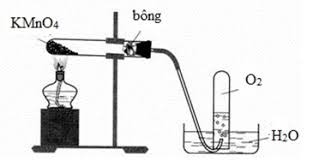
Khi điều chế khí oxi trong phòng thí nghiệm (sơ đồ hình bên), người ta thường thu khí O2 bằng cách đẩy nước là do khí oxi:
Cho 0,1 mol SO2 hấp thụ hết vào dung dịch chứa 0,2 mol NaOH. Chất tan có trong dung dịch sau phản ứng là:
Chất nào sau đây khi cho vào hồ tinh bột tạo thành hợp chất có màu xanh?
Ở điều kiện thường, trạng thái vật lí nào sau đây là của clo?
Nhỏ dung dịch AgNO3 vào dung dịch chất nào sau đây sẽ thu được kết tủa màu trắng ?
Nhóm gồm các chất đều có khả năng phản ứng với axit H2SO4 đặc, nguội là:
Phương trình hóa học nào sau đây viết sai?
Phát biểu nào sau đây là sai khi nói về lưu huỳnh ?
Lưu huỳnh là chất khử trong phản ứng nào sau đây ?
Nhóm chất đều tác dụng với dung dịch HCl là
X là một loại muối clorua, là nguyên liệu quan trọng trong công nghiệp hóa chất để điều chế Cl2, H2, NaOH, nước Gia-ven,…. Đặc biệt, X có vai trò quan trọng trong bảo quản thực phẩm và làm gia vị thức ăn. X là:
Cho m gam hỗn hợp X gồm Fe, FeO và FeS tác dụng với dung dịch HCl dư, thu được 0,2 mol hỗn hợp khí Y gồm H2 và H2S, có tỉ lệ mol 1 : 1. Tính thể tích mỗi khí trong hỗn hợp Y.
Người ta đã sử dụng nhiệt độ của phản ứng đốt cháy than đá để nung vôi, biện pháp kỹ thuật nào sau đây không được sử dụng để tăng tốc độ phản ứng nung vôi?
Các chất đốt như than, củi,...có kích thước nhỏ hơn sẽ cháy nhanh hơn. yếu tố ảnh hưởng đến tốc độ phản ứng trên là?
Dung dịch axit tác dụng được với chất nào sau đây?
Đốt cháy hoàn toàn m gam FeS2 thu được 2,24 lít khí SO2. Gía trị của m là?
Phương pháp để điều chế khí O2 trong PTN là?
Người ta lợi dụng yếu tố nào sau đây để làm tăng tốc độ phản ứng khi nung đá vôi ở nhiệt độ cao trong quá trình sản xuất vôi sống?
Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh?
Chất nào sau đây tan trong nước nhiều nhất?
S + H2SO4đ → X + H2O. Vậy X là?
Chất X là chất khí ở điều kiện thường, có màu vàng lục dùng để khử trùng nước sinh hoạt. Chất X là?
Nguyên tử các nguyên tố nhóm VIIA có cấu hình e lớp ngoài cùng là?
Cho phản ứng Br2 + HCOOH → 2HBr + CO2
Ban đầu nồng độ của Br2 là 0,096 mol/l, sau 2 phút nồng độ Br2 là 0,012 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong thời gian trên là?
Có 3 bình đựng 3 chất khí riêng biệt : O2, O3, H2S lần lượt cho từng chất này qua dung dịch KI có pha thêm hồ tinh bột, chất khí làm dung dịch chuyển màu xanh là?
Cặp thuốc thử dùng để phân biệt 3 dung dịch không màu sau: NaCl, Na2SO4, H2SO4 là?