
Đề thi giữa HK2 môn Hóa học 10 năm 2021
Đề thi nằm trong bộ sưu tập: HÓA 10
Số câu hỏi: 40 câuSố mã đề: 1 đềThời gian: 1 giờ
129,957 lượt xem 9,993 lượt làm bài
Xem trước nội dung:
Khí oxi điều chế được thường có lẫn hơi nước. Để thu được khí oxi khô, người ta thường dẫn hỗn hợp khí thu được đi quã
Trường nào không xảy ra phản ứng hóa học?
Phát biểu nào sau đây là đúng khi nói về phản ứng
Cách sơ cứu hiệu quả nhất để hạn chế tối đa tác hại của tai nạn do uống nhầm axit sunfuric (H2SO4) là:
Trong phòng thí nghiệm, oxi thường được điều chế bằng cách nào dưới đây?
Đốt cháy hoàn toàn m gam hỗn hợp các kim loại gồm Al, Fe, Mg cần vừa đủ 6,72 lít khí O2 ( đktc). Sau phản ứng thu được 24,6 gam hỗn hợp chất rắn. Giá trị của m là
Đốt cháy hoàn toàn m gam FeS2 thu được 2,24 lít khí SO2 ( đktc). Giá trị của m là
Một hợp chất có thành phần theo khối lượng là 1,12%H; 35,96%S; còn lại là oxi. Hợp chất này có công thức phân tử là
Trái cây được bảo quản lâu hơn trong môi trường vô trùng. Trên thực tế, người ta dùng nước ozon để bảo quản trái cây. Ứng dụng trên dựa trên tính chất nào sau đây?
Cho 3,68 gam hỗn hợp CaCO3 và CaO phản ứng vừa đủ với 0,5 lít dung dịch HCl thu được 0,448 lít khí (đktc). Thành phần phần trăm khối lượng của CaCO3 và CaO trong hỗn hợp ban đầu là
Hòa tan hoàn toàn 11,9 gam hỗn hợp X gồm Al và Zn bằng dung dịch HCl dư thu được 8,96 lít khí H2 (đktc). Thể tích O2 (đktc) cần dùng để phản ứng hoàn toàn hỗn hợp X trên là
Kem đánh răng chứa một lượng muối flo ( như CaF2, SnF2 ) có tác dụng bảo vệ lớp men răng vì nó thay thế một phần hợp chất có trong men răng là Ca5(PO4)3OH thành Ca5(PO4)3F. Điều này có ý nghĩa quan trọng trong bảo vệ răng vì lớp Ca5(PO4)3F
Dãy nguyên tố nào dưới đây được xếp theo chiều tính oxi hóa tăng dần?
Đổ dung dịch AgNO3 vào dung dịch muối nào sau đây sẽ có kết tủa màu trắng xuất hiện?
Nguyên nhân chủ yếu làm cho đơn chất clo có tính oxi hóa mạng hơn đơn chất nitơ ở điều kiện thường là
“Chảo chống dính” cõ lẽ là vật dụng không thể thiếu với các bà nội trợ hiện nay bởi những công dụng tuyệt vời của nó như: chiên thức ăn không bị dính, tiết kiệm dầu ăn... Sở dĩ, “không dính” vì mặt trong của chảo được tráng một lớp polime nhiệt dẻo có tính bền cao với các dung môi và hóa chất. Hợp chất được nhắc tới trong trường hợp này là
Đặc điểm chung của các nguyên tố nhóm halogen là
Đầu thế kỷ 19 người ta sản xuất natri sunfat bằng cách cho axit sunfuric đặc tác dụng với muối ăn. Khi đó, xung quanh các nhà máy sản xuất bằng cách này, dụng cụ của thợ thủ công rất nhanh hỏng và cây cối bị chết rất nhiều. Người ta đã cố gắng cho thoát khí thải thoát ra bằng những ống khói cao tới 300m nhưng tác hại của khí thải vẫn tiếp diễn, đặc biệt là khí hậu ẩm. Hãy chó biết khí thải đó có chứa thành phần chủ yêu nào trong các chất sau?
Cho 500 ml dung dịch NaOH 1,8 M phản ứng với 500 ml dung dịch FeCl3 0,8 M thu được dung dịch A và chất rắn B. khối lượng chất rắn B là
Clorua vôi là hỗn hợp của
Clo vừa là chất oxi hóa vừa là chất khử trong phản ứng của clo với
Cho dung dịch sắt (II) clorua, thêm dư vào dung dịch axit clohiđric, sau đó thêm 0,5 gam một hỗn hợp muối kali clorua và kali nitrat. Sau phản ứng thu được 100 ml một chất khí (ở đktc và đã được làm khô). Thành phần phần trăm về khối lượng của hỗn hợp muối kali chorua và kali nitrat lần lượt là
Brom bị lẫn tạp chất là clo, để thu được brom cần làm cách nào sau đây?
Cho hình vẽ sau
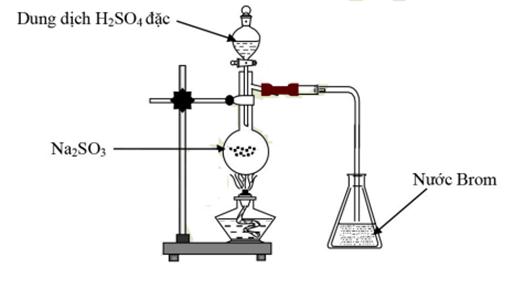
Hiện tượng xảy ra trong bình eclen chứa brom là
Có các hóa chất: K2Cr2O7, HCl, KMnO4, MnO2, NaCl, HClO, H2SO4, KClO3. Những chất được sử dụng để điều chế Cl2 trong phòng thí nghiệm là
Để điều chế được 16,25 gam FeCl3 cần cho sắt phản ứng vừa đủ với V lít khi clo (đktc). Giá trị của V là
Cho biết số hiệu nguyên tử của các nguyên tố N, F và P lần lượt là 7, 9 và 15. Dựa vào cấu hình electron và qui luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn, hãy so sánh tính phi kim của P và F.
Nhận định nào sau đây sai khi nói về flo?
Cho hỗn hợp gồm các chất sau: Mg(HCO3), CuO, Ag, CuS, KOH, KNO3, Fe(OH)3, Na2SO4. Số chất có khả năng tác dụng với dung dịch HCl là
Để nhận biết 5 lọ mất nhãn đựng các dung dịch: HCl, KOH, Ca(NO3)2, BaCl2, thuốc thử cần dùng là
Hòa tan 31,6 gam KMnO4 bằng một lượng vừa đủ 400 ml dung dịch HCl thu được V lít khí (đktc). Giá trị của V là
Cho các phát biểu sau
(a) Đổ dung dịch AgNO3 vào dung dịch NaF thu được kết tủa.
(b) Người ta dùng lọ thủy tinh để đựng dung dịch axit flohiđric.
(c) Clorua vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
(d) Tính oxi hóa của các đơn chất halogen giảm theo thứ tự I2, Br2, Cl2, F2.
Phát biểu đúng là
Phát biểu nào sau đây không đúng?
Trong phản ứng hóa học sau:
.
Vai trò của Br2 là
Để điều chế clo trong công nghiệp ta phải dùng điện phân có màng ngăn cách hai điện cực để
Cho phương trình:
Tỉ lệ giữa số phân tử HCl đóng vai trò là chất khử và số phân tử HCl tham gia phản ứng
Cho dung dịch chứa 6,03 gam hỗn hợp gồm hai muối NaX và NaY ( X, Y là hai nguyên tố có trong tự nhiên, ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dung dịch AgNO3 (dư), thu được 8,61 gam kết tủa. Phần trăm khối lượng của NaX trong hỗn hợp ban đầu là
Dung dịch HCl không tác dụng với cặp chất nào sau đây?
Hòa tan khí clo vào dung dịch KOH đặc nóng, dư thu được dung dịch chứa các chất thuộc dãy nào sau đây?
Nguyên tử của nguyên tố (A) có tổng số hạt p,n,e là 34 trong đó tỉ lệ giữa số hạt mang điện và hạt không mang điện là 11: 6. Số hạt không mang điện trong nguyên tử A là
