
Đề thi giữa HK2 môn Hóa học 10 năm 2021
Đề thi nằm trong bộ sưu tập: HÓA 10
Số câu hỏi: 40 câuSố mã đề: 1 đềThời gian: 1 giờ
98,791 lượt xem 7,596 lượt làm bài
Xem trước nội dung:
Hòa tan kim loại R trong m gam dung dịch H2SO4 đặc, nóng. Sau khi SO2 (sản phẩm khí duy nhất) bay ra hết thì dung dịch còn lại có khối lượng m gam. Kim loại R là
Khi cho O3 tác dụng lên giấy tẩm dung dịch hồ tinh bột và KI, thấy xuất hiện màu xanh. Hiện tượng này xảy ra là do
Hoà tan hoàn toàn 2,81g hỗn hợp gồm Fe2O3, MgO, ZnO trong 500ml dd H2SO4 0,1M (vừa đủ). Sau phản ứng, cô cạn dung dịch thu được muối khan có khối lượng là:
Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl khí có tỉ khối so với hiđro là 9. Thành phần % theo khối lượng Fe trong hỗn hợp ban đầu là
Cho 13,92 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3 (trong số đó số mol FeO bằng số mol Fe2O3) tác dụng vừa đủ dung dịch H2SO4 loãng được dung dịch X. Sục khí clo vào dung dịch X đến khi phản ứng xong được dung dịch Y. Cô cạn dd Y được m gam muối khan. Giá trị của m là
Cho sơ đồ phản ứng:
S + H2SO4 (đặc, nóng) → X + H2O. X là
Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này gồm bao nhiêu công đoạn chính?
Nguyên tắc pha loãng axit sunfuric đặc là
Chất dùng để làm khô khí Cl2 ẩm là
Hợp chất nào sau đây vừa thể hiện tính oxi hóa, vừa thể hiện tính khử?
Trong nhóm oxi, theo chiều tăng dần của điện tích hạt nhân:
Tầng ozon có khả năng ngăn tia cực tím từ vũ trụ thâm nhập vào trái đất vì
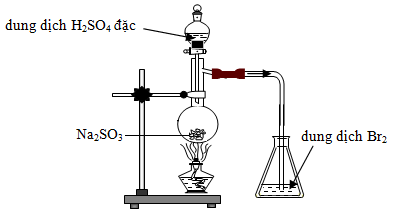
Cho biết phản ứng nào xảy ra trong bình cầu?
Kim loại nào dưới đây có phản ứng với axit H2SO4 đặc, nguội?
Hòa tan m gam Fe trong dung dịch H2SO4 loãng thì sinh ra 3,36 lít khí (đktc). Nếu cho m gam Fe này vào dung dịch H2SO4 đặc nóng thì lượng khí (đktc) sinh ra là
Hiđro peoxit tham gia các phản ứng hóa học:
H2O2 + 2KI → I2 + 2KOH (1)
H2O2 + Ag2O → 2Ag + H2O + O2 (2).
Nhận xét nào đúng?
Cấu hình lớp electron ngoài cùng của các nguyên tố nhóm oxi là:
Khi sục SO2 vào dung dịch H2S thì
Để phân biệt được 3 chất khí: CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt, người ta dùng thuốc thử lần lượt là:
Cho các phát biểu sau:
(1) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoành toàn.
(2) Khi thay đổi trạng thái cân bằng của phản ứng thuận nghịch, cân bằng sẽ chuyển dịch về phía chống lại sự thay đổi đó.
(3) Chất xúc tác làm tăng tốc độ của phản ứng thuận bao nhiêu lần thì làm giảm tốc độ của phản ứng nghịch bấy nhiêu lần.
(4) Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt.
(5) Khi tăng áp suất chung của hệ thì cân bằng luôn chuyển dịch theo chiều thuận.
(6) Trong hệ cân bằng có chất rắn, thì việc thêm hoặc bớt lượng chất rắn cũng không ảnh hưởng đến cân bằng.
Số phát biểu sai là
Đun nóng 22,12 gam KMnO4 thu được 21,16 gam hỗn hợp chất rắn. Cho hỗn hợp chất rắn tác dụng với dung dịch HCl đặc thì lượng khí clo thoát ra là
Hòa tan hoàn toàn 2,72 gam hỗn hợp CaC2 và Al4C3 vào dung dịch HCl 2M ta thu được một lượng hỗn hợp khí có tỷ khối so với H2 là 10. Số mol CaC2 và Al4C3 lần lượt là
Khi sục khí clo vào dung dịch NaOH ở nhiệt đọ thường ta được một dung dịch có tên gọi là nước Javen. Nó có tên gọi như vậy vì lần đầu tiên được Bectôlê điều chế ở thành phố Javen gần Paris (Pháp). Nước Javen có tính oxi hóa mạnh được dùng để tẩy trắng sợi, vải, giấy. nó cũng được dùng để sát trùng và tẩy uế nhà vệ sinh hoặc nhũng khu vực bị ô nhiễm khác. Thành phần của nước Javen là
Sục 7,84 lít khí SO2 ở đktc vào 500 ml dung dịch KOH 2M thu được dung dịch X. Nồng độ mol/l của các chất trong dung dịch X là
Cho cân bằng trong bình khí như sau:
C\left( r \right) + {H_2}O\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} CO\left( k \right) + {H_2}\left( k \right),\Delta H > 0
Trong các yếu tố : (1) tăng nhiệt độ, (2) thêm một lượng hơi nước, (3) thêm một lượng H2, (4) tăng áp suất chung của hệ, (5) dùng chất xúc tác. Dãy gồm các yếu tố đều làm cân bằng chuyển dịch theo chiều thuận là
Cho các bước tiến hành thí nghiệm SO2 từ Na2SO3 và H2SO4 đặc như sau
(1) Cho vào ống nghiệm có nhánh một lượng nhỏ Na2SO3.
(2) Nối ống của ống nghieemj có nhánh với ống dẫn thủy tinh thẳng bằng ống dẫn cao su.
(3) Bóp nhẹ quả bóp cao su cho H2SO4 đặc chảy xuống và tác dụng với Na2SO3.
(4) Đậy ống nghiệm bằng nút cao su có kèm ống nhỏ giọt chứa H2SO4 đặc.
(5) Kẹp ống nghiệm lên giá.
(6) Nhúng đầu ống dẫn thủy tinh vào eclen khô dùng để thu khí SO2, đậy miệng eclen bằng bông tẩm dung dịch NaOH.
Thứ tự các bước tiến hành thí nghiệm là
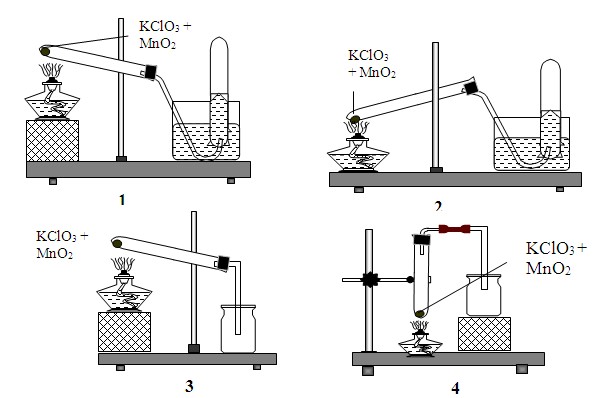
Trong phòng thí nghiệm, để điều chế một lượng nhỏ khí oxi tinh khiết, người ta thường nhiệt phân các hợp chất giàu oxi và kém bền với nhiệt như KMnO4, KClO3... và có thể thu được bằng cách đẩy nước hay không khí. Mô hình điều chế oxi đúng nhất là
Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu.
(c) Dung dịch NaF loãng được dùng làm thuốc chống sâu răng.
(d) Trong hợp chất, các halogen (F,Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7.
(e) Tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-.
Số phát biểu đúng là
Hòa tan hoàn toàn 8,8g hỗn hợp Mg và CuO vào dung dịch HCl dư. Sau phản ứng thu được 4,48 lít khí H2 (đktc). Số mol axit HCl đã tham gia phản ứng là
Hòa tan 22,8 gam hỗn hợp A gồm Mg và Fe vào dung dịch H2SO4 80% (đặc, nóng, vừa đủ). Sau khi phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 là sản phẩm khử duy nhất (ở đktc) và dung dịch B. Thành phần phần % khối lượng của Mg trong hỗn hợp A là
Cho m gam hỗn hợp gồm Mg, Zn, Fe tác dụng hết với dung dịch HCl loãng thu được 6,72 lít khí (đktc). Cô cạn dung dịch sau phản ứng thu được 43,3 gam muối khan. Giá trị của m là
Kim loại nào sau đây không tác dụng với dung dịch HCl?
Kim loại M phản ứng được với dung dịch HCl, dung dịch H2SO4 đặc nguội. Kim loại M là:
Để trung hòa 30 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ x mol/l. Giá trị của x là:
Trong các chất sau, chất nào dễ tan trong nước?
Trường hợp nào sau đây xảy ra phản ứng hóa học?
Trong điều kiện thích hợp, xảy ra các phản ứng sau:
(a) 2H2SO4 + C → 2SO2 + CO2 + 2H2O
(b) 4H2SO4 + 2FeO → Fe2(SO4)3 + SO2 + 4H2O
(c) 6H2SO4 + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
(d) H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
Trong các phản ứng trên, phản ứng xảy ra tương ứng với tính chất của dung dịch H2SO4 loãng là:
Cho dãy các kim loại: Zn, Al, Cu, Fe, Ag. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là:
Cho 2,7 gam Al tác dụng hoàn toàn với dung dịch H2SO4 loãng, dư. Sau khi phản ứng kết thúc, thể tích khí H2 (đktc) thoát ra là:
Cho 15,68 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 22,2 gam hỗn hợp Y gồm Mg và Al, thu được 60,2 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là:
