
Trắc nghiệm tổng hợp ôn thi tốt nghiệp THPT môn Hóa Bài 12. Điện phân có đáp án
Tài liệu ôn luyện trắc nghiệm môn Hóa học, bài 12 về "Điện phân". Nội dung bao gồm các kiến thức cơ bản về quá trình điện phân, ứng dụng thực tế và cách giải các bài tập liên quan. Tài liệu đi kèm với các câu hỏi trắc nghiệm được phân loại theo độ khó, đáp án chi tiết và lời giải cụ thể giúp học sinh ôn tập hiệu quả và chuẩn bị tốt nhất cho kỳ thi.
Từ khoá: Luyện thi tốt nghiệp THPT Hóa học Bài tập điện phân Trắc nghiệm Chủ đề pin điện và điện phân Đáp án chi tiết Luyện kỹ năng làm bài Ôn tập kiến thức Chuẩn bị kỳ thi Bài tập ứng dụng
Đề thi nằm trong bộ sưu tập: 📘 Tuyển Tập Bộ Đề Thi Ôn Luyện THPT Quốc Gia Môn Hóa Học Các Trường (2018-2025) - Có Đáp Án Chi Tiết 🧪📘 Tuyển Tập Đề Thi Tham Khảo Các Môn THPT Quốc Gia 2025 🎯
Số câu hỏi: 60 câuSố mã đề: 1 đềThời gian: 1 giờ
333,601 lượt xem 25,658 lượt làm bài
Xem trước nội dung:
Cho các phát biểu sau:
(a) Các chất tham gia phản ứng điện phân là các hợp chất ion.
(b) Trong đa số trường hợp, tại cực âm, chất có tính oxi hoá lớn hơn sẽ bị điện phân trước.
(c) Trong đa số trường hợp, tại cực dương, chất có tính khử lớn hơn sẽ bị điện phân trước.
(d) Tại các điện cực, các ion luôn bị điện phân trước các phân tử.
Số phát biểu đúng là
Cho các phản ứng sau:
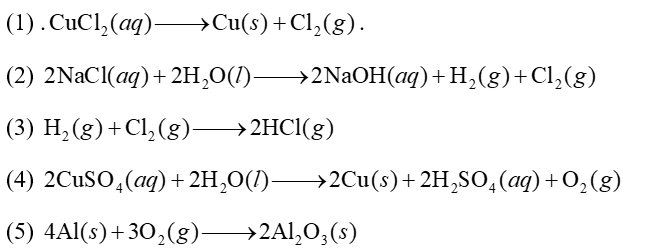
Số phản ứng xảy ra trong bình điện phân là
Điện phân các dung dịch chất điện li trong nước với các điện cực trơ. Cho các phát biểu sau:
(a) Khi có dòng điện chạy qua, các ion sẽ di chuyển về các điện cực trái dấu.
(b) Tại anode chỉ xảy ra quá trình oxi hoá các anion hoặc
(c) Tại cathode chỉ xảy ra quá trình khử các cation hoặc
(d) Khối lượng dung dịch điện phân giảm trong quá trìnhh điện phân.
Số phát biểu đúng là
Cho các quá trình sau:
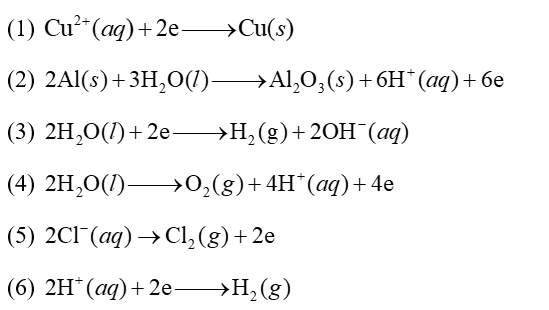
Những quá trình xảy ra tại cathode trong quá trình điện phân là
Điện phân dung dịch với các điện cực trơ. Các quá trình có thể xảy ra tại cathode như sau:
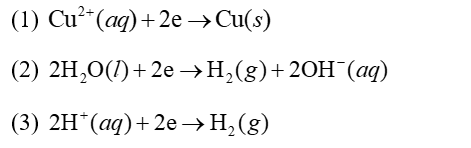
Thứ tự các quá trình điện phân tại cathode là
Điện phân nóng chảy hỗn hợp gồm aluminium oxide và cryolite để sản xuất nhôm trong công nghiệp. Cho các vai trò sau của cryolite:
(1) Tạo với thành hỗn hợp có nhiệt độ nóng chảy thấp hơn nhiều nhiệt độ nóng chảy
(2) Tăng khả năng dẫn điện của hỗn hợp điện phân do sự điện li tạo thành các ion.
(3) Hình thành lớp màng ngăn cản sự tiếp xúc giữa mới sinh với không khí.
Hãy cho biết những vai trò nào đúng với cryolite trong quá trình sản xuất nhôm trong công nghiệp.
Trong mỗi ý a, b, c, d ở mỗi câu, hãy chọn đúng hoặc sai.
Mỗi phát biểu sau là đúng hay sai?
a. Tại anode, chất (hoặc ion) có tính khử mạnh hơn thường bị điện phân trước.
b. Tại các điện cực, các ion trái dấu bị điện phân trước các phân tử trung hoà.
c. Tại cathode, chất (hoặc ion) có tính oxi hoá mạnh hơn thường bị điện phân trước.
d. Các ion cùng dấu với điện cực sẽ không bị điện phân tại điện cực đó.
Mô hình bể điện phân NaCl nóng chảy được biểu diễn như sau:
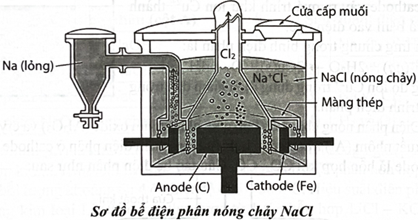
Mỗi phát biểu sau là đúng hay sai?
a. Tại anode xảy ra quá trình oxi hoá ion thành khí
b. Tại cathode xảy ra quá trình khử ion thành kim loại Na.
c. Sodium có khối lượng riêng nhỏ hơn khối lượng riêng của sodium chloride.
d. Phản ứng điện phân sodium chloride để điều chế kim loại Na xảy ra ở nhiệt độ thường.
Điện phân dung dịch NaCl có màng bán thẩm ngăn giữa anode với cathode (các điện cực đều là các điện cực trơ). Màng bán thẩm chỉ cho ion đi qua. Sơ đồ bình điện phân như hình bên:
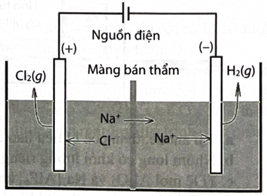
a. Tại cực dương xảy ra bán phản ứng khử ion thành khí
b. Tại cực âm xảy ra bán phản ứng oxi hoá thành khí và
c. Phản ứng chung trong bình điện phân là
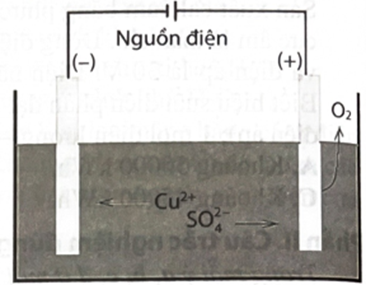
Điện phân dung dịch với hai cực đều làm bằng than chì (hình bên).
d. Lượng (số mol) trong dung dịch không đổi trong quá trình điện phân.
a. Tại anode xảy ra phản ứng oxi hoá ion và tạo thành khí
b. Tại cathode xảy ra bán phản ứng khử ion thành Cu.
c. Phản ứng chung trong bình điện phân là:
d. Màu xanh của dung dịch nhạt dần trong quá trình điện phân.
Điện phân dung dịch với các điện cực đều làm bằng Cu (hình bên).
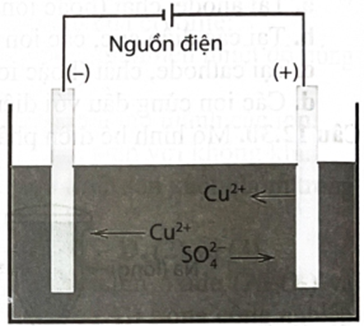
a. Tại anode xảy ra quá trình oxi hoá Cu thành ion khuếch tán vào dung dịch.
b. Tại cathode xảy ra quá trình khử ion thành Cu và bám vào điện cực.
c. Phản ứng chung trong bình điện phân là:
d. Nồng độ ion trong dung dịch giảm dần trong quá trình điện phân.
Điện phân nóng chảy hỗn hợp gồm aluminium oxide và cryolite để sản xuất nhôm trong công nghiệp. Sản phẩm điện phân ở cathode là nhôm (lỏng) và ở anode là hỗn hợp khí Cấu tạo bể điện phân như sau:
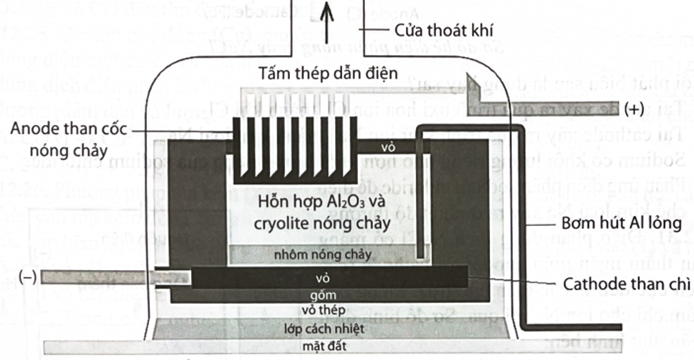
a. Tại anode, than cốc bị tiêu hao trong quá trình điện phân.
b. Nhôm lỏng có khối lượng riêng lớn hơn khối lượng riêng của cryolite.
c. Tỉ lệ mol và không thay đổi trong quá trình điện phân.
d. Khí thoát ra tại cửa thoát khí có thành phần chủ yếu là
Tinh luyện đồng bằng phương pháp điện phân được tiến hành như sau: Các khối đồng có độ tinh khiết thấp được gắn với cực dương của nguồn điện; các tấm đồng mỏng có độ tinh khiết cao được gắn với cực âm của nguồn điện. Dung dịch điện phân là dung dịch Sơ đồ bể điện phân như hình bên:
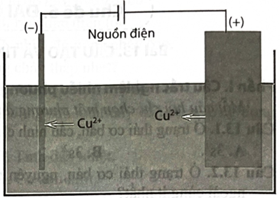
a. Tại anode chủ yếu xảy ra quá trình oxi hoá thành khí và
b. Các tạp chất không bị điện phân sẽ được giữ lại tại anode.
c. Nồng độ ion trong dung dịch không đổi trong quá trình điện phân.
d. Khối lượng Cu tan ra từ anode bằng khối lượng Cu bám vào cathode.
Hãy ghép các thí nghiệm điện phân với các sản phẩm chính của phản ứng điện phân. (Câu trả lời ghi số thứ tự sản phẩm của cột B ứng với thú tự của cột A)
| Thí nghiệm điện phân (cột A) |
| Sản phẩm điện phân (cột B) | ||
| a) | Điện phân dung dịch NaOH |
| 1) | và |
| b) | Điện phân nóng chảy NaCl |
| 2) | và |
| c) | Điện phân dung dịch NaCl (có màng ngăn) |
| 3) | Na và |
| d) | Điện phân NaOH nóng chảy |
| 4) | và |
Lithium (Li) là kim loại quan trọng trong các ngành công nghiệp như pin điện, chế tạo hợp kim,... Kim loại Li được điều chế bằng cách điện phân hỗn hợp với tỉ lệ khối lượng khoảng 6: 4 ở nhiệt độ Hiệu suất điện phân đạt 75%. Khối lượng kim loại Li (theo kg ) thu được từ 1 tấn hỗn hợp ban đầu là bao nhiêu?
(Làm tròn kết quả đến hàng phần mười)
Kim loại calcium ( Ca ) được điều chế bằng cách điện phân nóng chảy với dòng điện có cường độ 3000 A và điện áp Hiệu suất điện phân là 80%. Tính điện năng (theo kWh ) đã sử dụng điều chế 1 kg Ca .
(Làm tròn kết quả đến hàng phần mười)
Cho biết: Điện năng A được xác định bởi công thức: (với là số mol electron trao đổi giữa điện cực với các chất điện phân; ).
Điện phân nóng chảy hỗn hợp gồm và cryolite (90 %) với anode là than cốc và cathode là than chì. Sau thời gian điện phân thu được 5,4 tấn Al tại cathode và hỗn hợp khí tại anode gồm (80 theo thể tích) (20% theo thể tích). Giả thiết không có thêm sản phẩm nào được sinh ra trong quá trình điện phân. Tính khối lượng carbon (theo tấn) đã bị oxi hoá tại anode.
(Làm tròn kết quả đến hàng đơn vị)
Đề thi tương tự
10 mã đề 149 câu hỏi 1 giờ
184,774 xem14,203 thi
1 mã đề 30 câu hỏi 1 giờ
337,645 xem25,960 thi
1 mã đề 57 câu hỏi 1 giờ
292,222 xem22,472 thi
7 mã đề 113 câu hỏi 1 giờ
158,016 xem12,147 thi
6 mã đề 165 câu hỏi 1 giờ
177,458 xem13,642 thi
1 mã đề 28 câu hỏi 1 giờ
291,749 xem22,430 thi
1 mã đề 66 câu hỏi 1 giờ
305,905 xem23,526 thi
1 mã đề 20 câu hỏi 1 giờ
318,581 xem24,500 thi
4 mã đề 49 câu hỏi 1 giờ
160,564 xem12,344 thi
1 mã đề 28 câu hỏi 1 giờ
305,936 xem23,526 thi
