
Trắc nghiệm tổng hợp ôn thi tốt nghiệp THPT môn Hóa Bài 20. Sơ lược về kim loại chuyển tiếp dãy thứ nhất có đáp án
Từ khoá: Luyện thi tốt nghiệp THPT Hóa học Bài tập kim loại chuyển tiếp Trắc nghiệm Chủ đề hóa học kim loại Đáp án chi tiết Kiến thức cơ bản Ôn tập hiệu quả Chuẩn bị kỳ thi Rèn luyện kỹ năng
Đề thi nằm trong bộ sưu tập: 📘 Tuyển Tập Bộ Đề Thi Ôn Luyện THPT Quốc Gia Môn Hóa Học Các Trường (2018-2025) - Có Đáp Án Chi Tiết 🧪📘 Tuyển Tập Đề Thi Tham Khảo Các Môn THPT Quốc Gia 2025 🎯
Số câu hỏi: 55 câuSố mã đề: 1 đềThời gian: 1 giờ
350,671 lượt xem 26,968 lượt làm bài
Xem trước nội dung:
Cho các hợp chất của manganese: , và
Số hợp chất chứa nguyên tử Mn có số oxi hoá +3 là
Phản ứng chuẩn độ trong dung dịch acid bằng dung dịch được biểu diễn bởi phương trình ion rút gọn sau:
Chất oxi hoá trong phản ứng trên là
Một học sinh tiến hành chuẩn độ dung dịch bằng dung dịch theo hai cách như sau:
Cách 1. Nhỏ từ từ dung dịch vào dung dịch chứa trong môi trường acid cho đến khi xuất hiện màu hồng nhạt bền trong khoảng 30 giây.
Cách 2. Nhỏ từ từ dung dịch chứa trong môi trường acid vào dung dịch cho đến khi màu hồng của dung dịch biến mất. Hãy cho biết cách tiến hành chuẩn độ nào là phù hợp.
Chuẩn độ dung dịch và loãng bằng dung dịch Kết quả thu được như sau:
| Lần thứ | 1 | 2 | 3 |
| Thể tích dung dịch | 8,54 | 8,53 | 8,52 |
Nồng độ mol phù hợp nhất của trong dung dịch chuẩn độ là
Trong mỗi ý a, b, c, d ở mỗi câu, hãy chọn đúng hoặc sai.
Mỗi phát biểu sau là đúng hay sai?
a. Ở trạng thái cơ bản, lớp ngoài cùng của nguyên tử kim loại chuyển tiếp dãy thứ nhất có tối đa hai electron.
b. Nguyên tố kim loại chuyển tiếp dãy thứ nhất đều có nhiều số oxi hoá trong các hợp chất.
c. Phân lớp 3 d trong nguyên tử các kim loại chuyển tiếp dãy thứ nhất đều chưa bão hoà.
d. Các kim loại chuyển tiếp dãy thứ nhất đều là các nguyên tố nhóm B.
Nguyên tử sắt có cấu hình electron là Mỗi phát biểu sau là đúng hay sai?
Cho bảng số liệu sau của một số kim loại chuyển tiếp dãy thứ nhất như sau:
| Kim loại | Cr | Mn | Fe | Co |
| Cấu hình electron của nguyên tử |
|
|
|
|
|
|
|
|
|
|
a. Tính khử của các kim loại giảm dần theo chiều tăng của số hiệu nguyên tử.
b. Ở điều kiện chuẩn, kim loại manganese có thể khử được thành kim loại.
c. Ở trạng thái cơ bản, nguyên tử Cr có số electron độc thân lớn nhất trong các nguyên tử của các nguyên tố trên.
Thực nghiệm cho biết số oxi hoá của các kim loại chuyển tiếp dãy thứ nhất theo bảng sau:
| Nhóm | IIIB | IVB | VB | VIB | VIIB | VIIIB | VIIIB | VIIIB | IB |
| Nguyên tố |
|
|
|
|
|
|
|
|
|
| Các số oxi hoá |
|
|
|
|
|
|
|
|
|
|
|
|
|
| +6 |
|
|
|
| |
|
|
|
| +5 | +5 | +5 | +5 |
|
| |
|
|
|
| +4 |
| +4 | +4 | +4 |
| |
|
|
|
|
| +3 |
|
| +3 | +3 | |
| +2 | +2 | +2 |
|
|
|
|
|
| |
| +1 | +1 | +1 | +1 | +1 | +1 | +1 | +1 |
|
a. Các kim loại chuyển tiếp dãy thứ nhất đều có nhiều trạng thái oxi hoá.
b. Số oxi hoá cao nhất của các kim loại chuyển tiếp dãy thử nhất bằng số thứ tự của nhóm.
Titanium (Ti) được sử dụng để chế tạo động cơ hoặc khung máy bay, còn titanium dioxide được sử dụng trong sản xuất kem chống nắng. Quặng ilmenite có giá trị quan trọng về mặt kinh tế để sản xuất kim loại titanium. sản xuất từ (phản ứng A), sau đó được chuyển hoá thành Ti theo quy trình Kroll (phản ứng ).
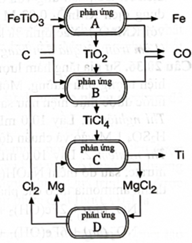
a. Phương trình hoá học của phản ứng A là:
b. Phương trình hoá học của phản ứng B là:
c. Phương trình hoá học của phản ứng C là:
d. Phương trình tổng cộng của 4 phản ứng là:
Chuẩn độ dung dịch chứa muối nồng độ và dung dịch loãng, đựng trong bình tam giác bằng dung dịch nồng độ để ở burette và để ở vạch 0. Khi vạch thể tích dung dịch trên burette là thì trong bình tam giác xuất hiện màu hồng bền trong khoảng 20 giây.
a. Phản ứng chuẩn độ là:
b. Khi màu hồng trong bình tam giác bền trong khoảng 20 giây thì có thể coi như phản ứng vừa đủ.
c. Mối quan hệ giữa và được biểu diễn qua biểu thức:
d. Có thể thực hiện phép chuẩn độ trên bằng cách đựng dung dịch ở bình tam giác và dung dịch chứa trong môi trường acid ở burette cho kết quả tương tự.
Cấu hình electron của sắt (Fe) là Xác định số electron độc thân trong ion
Titanium (Ti) là kim loại chuyển tiếp dãy thứ nhất và có cấu hình electron là Đa số ứng dụng của titanium liên quan đến vật liệu sản xuất động cơ và khung máy bay. Trong các hợp chất, số oxi hoá cao nhất của Ti là +a. Xác định giá trị của a.
Chromium có độ bền cơ học và hoá học rất cao, do đó người ta thường thêm Cr vào thép để chế tạo các loại thép không gỉ (inox). Biết số hiệu nguyên tử của chromium là 24. Xác định số electron độc thân trong ion
Chromium có tính cứng cao. Nickel có đặc tính cơ học là cứng, dễ dát mỏng, dễ uốn, dễ kéo sợi và đặc tính hoá học là trơ với không khí nên khi thêm vào inox để việc gia công dễ dàng hơn. Inox 18/10 có thành phần hoá học gồm 18% chromimum, 10% nickel và tối đa 0,08% carbon (C). Xác định khối lượng iron (tính theo kg) tối đa trong 1,00 tấn inox
Hoà tan hết 2 g mẫu chất rắn có thành phần chính là muối (muối Mohr) vào 20 mL dung dịch , thêm nước thu được dung dịch X. Để phản ứng vừa đủ với trong dung dịch X cần dùng dung dịch (Các chất và ion khác trong dung dịch không phản ứng với Xác định % khối lượng trong mẫu muối trên. (Làm tròn kết quả đến hàng phần mười)
Sự gia tăng hàm lượng nitrate trong nước là một trong những nguyên nhân của hiện tượng phú dưỡng. Một trong những quy trình xác định hàm lượng nitrate trong nước được thực hiện như sau:
Thí nghiệm 1. Lấy dung dịch muối Mohr thêm vào và chuẩn độ bằng dung dịch
Thí nghiệm 2. Lấy dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, sau đó thêm vào để đạt khoảng 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng:
Sau khi các phản ứng (1) và (2) hoàn toàn, lọc bỏ kết tủa, acid hoá dung dịch bằng dung dịch và chuẩn độ lượng dư bằng dung dịch (Các chất và ion khác trong dung dịch không phản ứng với ).
Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm 1 với thí nghiệm 2 sẽ tương ứng với bao nhiêu mg trong nước. (Làm tròn kết quả đến hàng phần mười)
Trong quá trình bảo quản, một phần trong muối bị oxygen oxi hoá thành (chất X). Lấy đem hoà vào dung dịch thu được dung dịch Y. Chia Y thành hai phần bằng nhau:
Phần 1. Thêm nước vào thu được 100 mL dung dịch Y 1. Lượng trong dung dịch Y 1 phản ứng vừa đủ với dung dịch
Phần 2. Cho qua cột chứa để khử hoàn toàn ion thành ion , thêm tiếp 5 mL dung dịch và nước vào dung dịch sau khi qua cột đến (dung dịch Y2). Lượng trong Y2 phản ứng vừa đủ với dung dịch .
Xác định % iron(II) đã bị oxygen trong không khí oxi hoá thành iron(III).
(Làm tròn kết quả đến hàng phần mười)
Đề thi tương tự
10 mã đề 149 câu hỏi 1 giờ
184,813 xem14,203 thi
1 mã đề 30 câu hỏi 1 giờ
337,656 xem25,960 thi
1 mã đề 57 câu hỏi 1 giờ
292,236 xem22,472 thi
7 mã đề 113 câu hỏi 1 giờ
158,053 xem12,147 thi
6 mã đề 165 câu hỏi 1 giờ
177,465 xem13,642 thi
1 mã đề 28 câu hỏi 1 giờ
291,766 xem22,430 thi
1 mã đề 66 câu hỏi 1 giờ
305,938 xem23,526 thi
1 mã đề 20 câu hỏi 1 giờ
318,592 xem24,500 thi
4 mã đề 49 câu hỏi 1 giờ
160,573 xem12,344 thi
1 mã đề 28 câu hỏi 1 giờ
305,946 xem23,526 thi
